中國粉體網訊 顆粒劑系指原料藥物與適宜的輔料混合制成具有一定粒度的干燥顆粒狀制劑。
顆粒劑可分為可溶顆粒(通稱為顆粒)、混懸顆粒、泡騰顆粒、腸溶顆粒,根據釋放特性不同還有緩釋顆粒等。
混懸顆粒 系指難溶性原料藥物與適宜輔料混合制成的顆粒劑。臨用前加水或其他適宜的液體振搖即可分散成混懸液。除另有規定外,混懸顆粒劑應進行溶出度(通則0931)檢查。
泡騰顆粒 系指含有碳酸氫鈉和有機酸,遇水可放出大量氣體而呈泡騰狀的顆粒劑。
泡騰顆粒中的原料藥物應是易溶性的,加水產生氣泡后應能溶解。有機酸一般用枸椽酸、酒石酸等。泡騰顆粒一般不得直接吞服。
腸溶顆粒 系指采用腸溶材料包裹顆粒或其他適宜方法制成的顆粒劑。腸溶顆粒耐胃酸而在腸液中釋放活性成分或控制藥物在腸道內定位釋放,可防止藥物在胃內分解失效,避免對胃的刺激。腸溶顆粒應進行釋放度(通則0931)檢查。腸溶顆粒不得咀嚼。
緩釋顆粒 系指在規定的釋放介質中緩慢地非恒速釋放藥物的顆粒劑。
緩釋顆粒應符合緩釋制劑(指導原則9013)的有關要求,并應進行釋放度(通則0931)檢查。緩釋顆粒不得咀嚼。
顆粒劑在生產與貯藏期間應符合下列規定。
一、原料藥物與輔料應均勻混合。含藥量小或含毒、劇藥物的顆粒劑,應根據原料藥物的性質采用適宜方法使其分散均勻。
二、除另有規定外,中藥飲片應按各品種項下規定的方法進行提取、純化、濃縮成規定的清膏,采用適宜的方法干燥并制成細粉,加適量輔料或飲片細粉,混勻并制成顆粒;也可將清膏加適量輔料或飲片細粉,混勻并制成顆粒。
三、凡屬揮發性原料藥物或遇熱不穩定的藥物在制備過程應注意控制適宜的溫度條件,凡遇光不穩定的原料藥物應遮光操作。
四、顆粒劑通常采用干法制粒、濕法制粒等方法制備。干法制粒可避免引入水分,尤其適合對濕熱不穩定藥物的顆粒劑的制備。
五、根據需要顆粒劑可加入適宜的輔料,如稀釋劑、黏合劑、分散劑、著色劑以及矯味劑等。
六、除另有規定外,揮發油應均勻噴入干燥顆粒中,密閉至規定時間或用包合等技術處理后加入。
七、為了防潮、掩蓋原料藥物的不良氣味,也可對顆粒進行包衣。必要時,包衣顆粒應檢查殘留溶劑。
八、顆粒劑應干燥,顆粒均勻,色澤一致,無吸潮、軟化、結塊、潮解等現象。
九、顆粒劑的微生物限度應符合要求。
十、根據原料藥物和制劑的特性,除來源于動、植物多組分且難以建立測定方法的顆粒劑外,溶出度、釋放度、含量均勻度等應符合要求。
十一、除另有規定外,顆粒劑應密封,置干燥處貯存,防止受潮。生物制品原液、半成品和成品的生產及質量控制應符合相關品種要求。
除另有規定外,顆粒劑應進行以下相應檢查。
【粒度】除另有規定外,照粒度和粒度分布測定法(通則0982第二法雙篩分法)測定,不能通過一號篩與能通過五號篩的總和不得超過15%。
【水分】中藥顆粒劑照水分測定法(通則0832)測定,除另有規定外,水分不得超過8.0%。
【干燥失重】除另有規定外,化學藥品和生物制品顆粒劑照干燥失重測定法(通則0831)測定,于105℃干燥(含糖顆粒應在80℃減壓干燥)至恒重,減失重量不得超過2.0%。
【溶化性】除另有規定外,顆粒劑照下述方法檢查,溶化性應符合規定。含中藥原粉的顆粒劑不進行溶化性檢查。
可溶顆粒檢查法 取供試品10g(中藥單劑量包裝取1袋),加熱水200ml,攪拌5分鐘,立即觀察,可溶顆粒應全部溶化或輕微渾濁。
泡騰顆粒檢查法 取供試品3袋,將內容物分別轉移至盛有200ml水的燒杯中,水溫為15~25℃,應迅速產生氣體而呈泡騰狀,5分鐘內顆粒均應完全分散或溶解在水中。
顆粒劑按上述方法檢查,均不得有異物,中藥顆粒還不得有焦屑。
混懸顆粒以及已規定檢查溶出度或釋放度的顆粒劑可不進行溶化性檢查。
【裝量差異】單劑量包裝的顆粒劑按下述方法檢查,應符合規定。
檢查法 取供試品10袋(瓶),除去包裝,分別精密稱定每袋(瓶)內容物的重量,求出每袋(瓶)內容物的裝量與平均裝量。每袋(瓶)裝量與平均裝量相比較[凡無含量測定的顆粒劑或有標示裝量的顆粒劑,每袋(瓶)裝量應與標示裝量比較],超出裝量差異限度的顆粒劑不得多于2袋(瓶),并不得有1袋(瓶)超出裝量差異限度1倍。
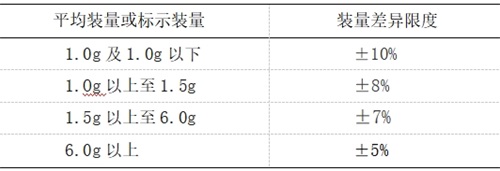
凡規定檢查含量均勻度的顆粒劑,一般不再進行裝量差異檢查。
【裝量】多劑量包裝的顆粒劑,照最低裝量檢查法(通則0942)檢查,應符合規定。
【微生物限度】以動物、植物、礦物質來源的非單體成分制成的顆粒劑,生物制品顆粒劑,照非無菌產品微生物限度檢查:微生物計數法(通則1105)和控制菌檢查法(通則1106)及非無菌藥品微生物限度標準(通則1107)檢查,應符合規定。規定檢查雜菌的生物制品顆粒劑,可不進行微生物限度檢查。
(中國粉體網編輯整理/青黎)
注:圖片非商業用途,存在侵權告知刪除

















