中國粉體網訊 化療是一種重要的癌癥治療手段,但是化療藥物往往具有嚴重的毒副作用且很難達到令人滿意的治療效果,因而其在臨床上的應用仍有待改善。腫瘤靶向藥物遞送是一種極具潛力的新型治療手段,該類技術能有效增加化療藥物在靶部位的濃度同時降低其在健康組織器官內的蓄積,最終提高化療的療效和安全性。
在眾多靶向藥物遞送載體中,聚合物膠束是目前應用最廣泛且最成功的載體之一。聚合物膠束是由兩親性嵌段共聚物通過自組裝形成的納米級藥物載體,具有一個親水性的外殼和一個疏水性的內核。
聚合物膠束的親水性外殼能夠維持其結構穩定性,其疏水性內核可以用于裝載難溶性化療藥物。因而,聚合物膠束特別適用于難溶性化療藥物如紫杉醇和多西紫杉醇的腫瘤靶向遞送。目前已有十余個基于聚合物膠束載體的腫瘤靶向納米藥物成功進入臨床試驗階段。
盡管如此,全球多個課題組的研究結果表明,傳統的聚合物膠束在血液循環中表現出較明顯的不穩定性和藥物突釋效應,大大降低了載藥聚合物膠束的腫瘤靶向效率。
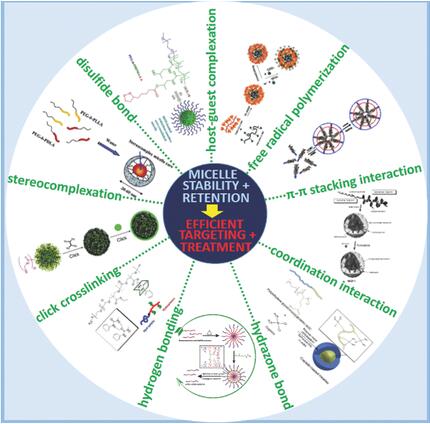
最近,由來自荷蘭烏特勒支大學的海寧克教授(Prof. W.E. Hennink),華南理工大學的石洋副教授,德國亞琛工業大學的拉默斯教授(Prof. T. Lammers)和荷蘭屯特大學的斯道姆教授(Prof. G. Storm)共同撰文的Macromolecular Bioscience特邀綜述(DOI: 10.1002/mabi.201600160)討論了造成聚合物膠束靶向效率低的原因,以及針對此問題的解決辦法。經靜脈注射的聚合物膠束由于血液的稀釋作用以及聚合物與血液內各種成分的相互作用,其結構往往會遭到破壞并導致所包封的藥物釋放至血液內。另外,藥物還可以從聚合物膠束的內核轉移至血液循環內導致藥物突釋效應。上述兩個過程單獨或綜合起來均可極大地降低聚合物膠束所包封的藥物在血液循環中的半衰期,因而難以充分利用腫瘤的高通透性和滯留效應(EPR effect)達到滿意的腫瘤靶向效果。
該專欄文章綜述了用于解決這一問題最有效的幾種物理作用力(π-π堆積、立構復合、氫鍵、主客體包絡、配位作用)及化學方法(自由基聚合、點擊化學、雙硫鍵、腙鍵)。以上方法可顯著提高聚合物膠束的腫瘤靶向效率,并已促成近十個基于聚合物膠束的靶向納米藥物進入臨床試驗階段。

















